III-) Identification de la nature d'un pigment par réactions chimiques colorées
Différentes techniques permettent l'identification du pigment entre autres les réactions colorées dont certaines sont énoncées plus bas. Elles servent à établir la nature du composé chimique par une approche qualitative, elles sont notamment employées au laboratoire de chimie de l'art à l'université d'Avignon.
a) Les réactions acido-basiques
Pour Brönsted, un acide est un donneur de proton et une base un donneur de doublet d'électrons. Ici, nous nous servirons de la définition de Lewis qui est plus large : un acide est un accepteur de doublet d'électrons et une base un donneur de doublet d'électrons.
C'est pourquoi l'expérience suivante à partir de l'oxyde de zinc montre clairement l'utilité de ces réactions en chimie de l'art. En effet, l'oxyde de zinc est amphotère, c'est-à-dire qu'il a les propriétés des bases et des acides, qu'il peut se combiner aussi bien avec les bases qu'avec les acides. La dissolution dans un acide ou dans une base provoque une décoloration. A partir de ces réactions nous pouvons écrire les équations suivantes :
dans l'acide : ZnO(s) + 2H3O+(aq) → Zn2+(aq) + 3H2O(aq)
dans la base : ZnO(s) + 2OH-(aq) + H2O(aq) → Zn(OH)42-(aq)
blanc
incolore
Cette décoloration permet la caractérisation de l'oxyde de zinc. De plus, d'après le tableau synoptique (cf : II)- Le Pigment ) l'oxyde de zinc n'est apparu en peinture qu'à partir de 1834, son identification sert donc une à datation indirecte du tableau.
http://www.youtube.com/watch?v=Tkqi7EQPs_Y
b) La précipitation
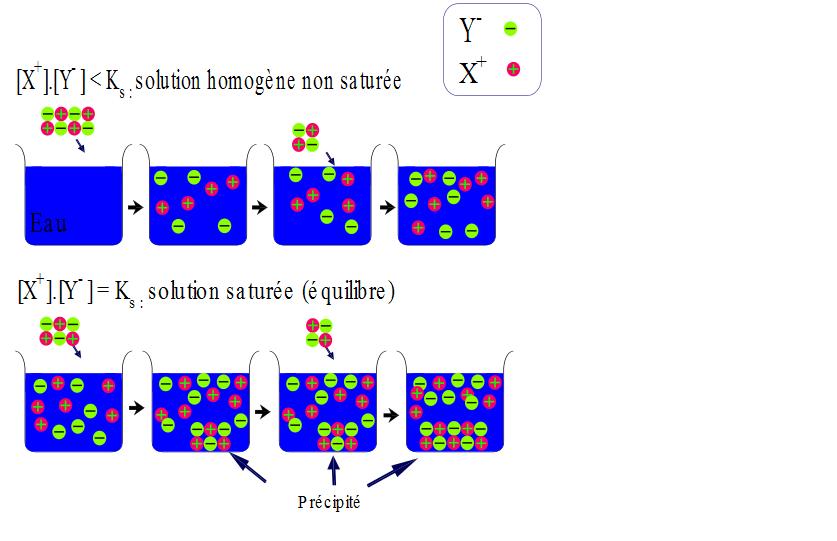
Un grand nombre de composés ont une solubilité limitée. La solubilité d'un composé est la quantité maximale (en g ou en mole) de soluté dissous dans 1 litre de solution saturée dans des conditions précises de température, de nature du solvant et du soluté. La solution est dite saturée si elle contient une quantité supérieure ou égale à la solubilité du soluté. De plus, un composé est considéré comme soluble lorsque sa solubilité dépasse les 0,1g/mol.
Par ailleurs, il existe une constante d'équilibre appelée produit de solubilité et notée Kps (ou Ks) qui est donnée par la formule suivante : ![]()
pour un solide ionique de formule :
![]()
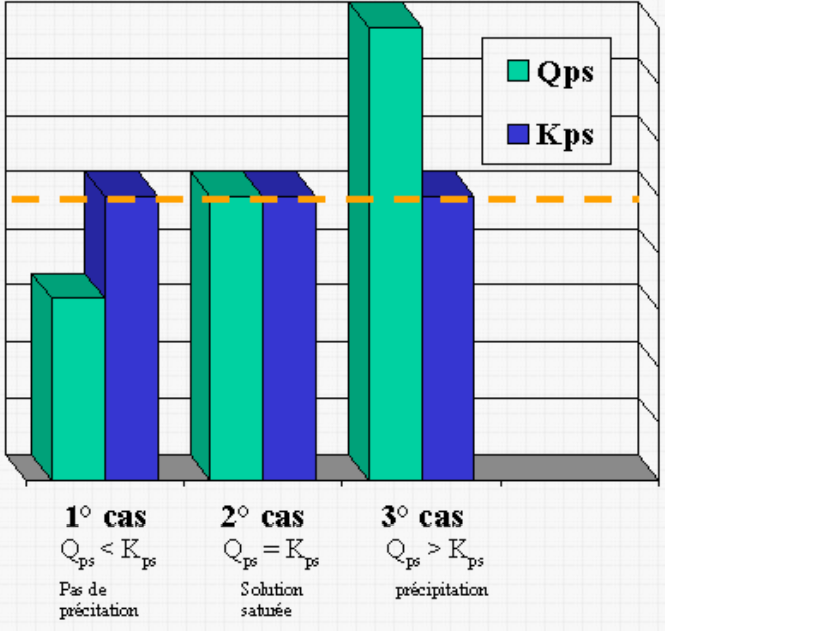
Or, il existe une deuxième constante, le quotient réactionnel, notée Qps de même forme mathématique mais qui quant à elle, correspond aux concentrations initiales de réactifs.
C'est pourquoi, lorsqu'il y a un déséquilibre de concentration, soit que Qps>Kps , un précipité apparaît et consomme des ions en solution jusqu'à ce que la constante d'équilibre soit vérifiée.
La couleur du précipité est caractéristique des ions mis en présence ainsi il est possible de connaître la nature de l'ion introduit, soit la nature du pigment. Quelques précipités reconnaissables sont donnés dans le tableau suivant : 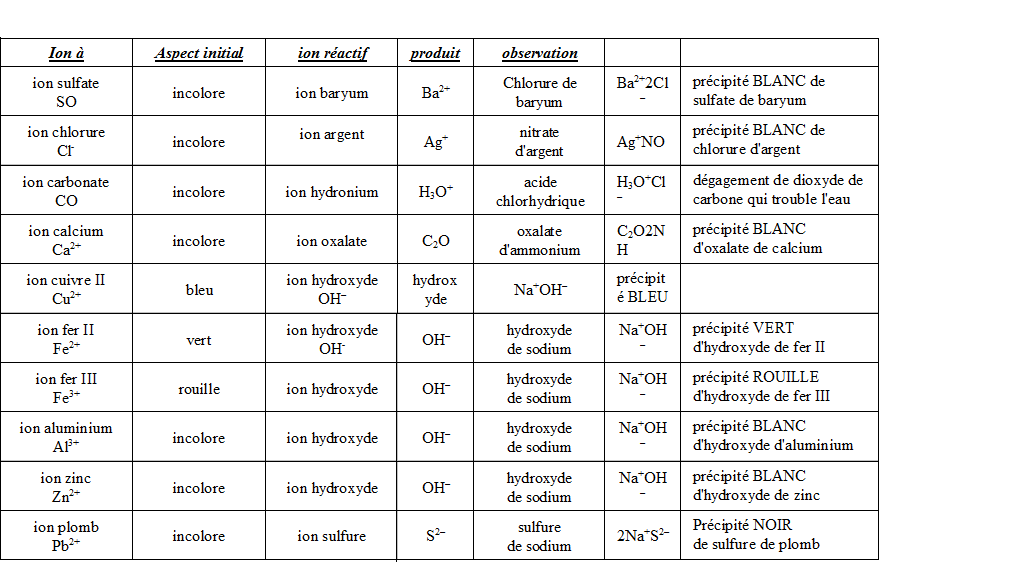
Un autre phénomène peut être observé, il s'agit de la complexation, expliquée ci-dessous :
La formation d'un complexe est due :
- à un ou plusieurs cations (le plus souvent métallique) qui se trouve entouré
- de plusieurs ligands qui sont des molécules ou des ions possédant au moins un doublet d'électrons libres et qui ainsi délocalisent une partie de leur densité électronique sur le cation, formant des liaisons de type coulombiennes (« charge + attirant charge - ») avec celui-ci.
De même que la précipitation, la couleur du complexe formé permet de remonter aux espèces chimiques mises en présence puisqu'elle leur est caractéristique.
De gauche à droite, des solutions aqueuses de :
- nitrate de cobalt(II), Co(NO3)2 (rouge);
- dichromate de potassium, K2Cr2O7 (orange);
- chromate de potassium, K2CrO4 (jaune);
- chlorure de nickel(II), NiCl2 (vert);
- sulfate de cuivre(II), CuSO4 (bleu);
- permanganate de potassium, KMnO4 (violet).
d) Conclusion
Toutes ces réactions chimiques permettent la connaissance plus ou moins précise de la nature du pigment et donc, à partir d'un tableau synoptique, une approche de datation d'œuvres d'art mais aussi une restauration curative plus efficace.